- · 牙体牙髓牙周病学杂志版[01/26]
- · 《牙体牙髓牙周病学杂志[01/26]
- · 《牙体牙髓牙周病学杂志[01/26]
生物材料在牙髓再生治疗中的应用(3)
作者:网站采编关键词:
摘要:图1 示意图展示一种临床可行的细胞归巢方法,用于在死髓年轻恒牙中再生牙髓(a),以及再生过程中根管系统中可能发生的细胞归巢方法相关的一系列事
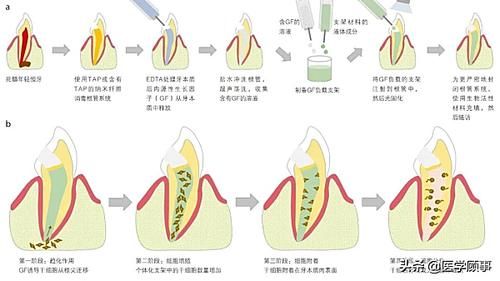
图1 示意图展示一种临床可行的细胞归巢方法,用于在死髓年轻恒牙中再生牙髓(a),以及再生过程中根管系统中可能发生的细胞归巢方法相关的一系列事件/阶段(b)。在图a中,根管系统的消毒对于清除细菌至关重要,然后使用EDTA溶液处理牙本质长达10分钟,这有助于内源性生长因子(GF)的释放;接下来,在超声荡洗下用盐水冲洗根管,收集GF。然后将含GF的溶液与支架材料的液体成分混合,形成载有GF的支架/水凝胶,将其注入根管系统,随后聚合(例如,通常由于支架材料中的光引发剂而发生光聚合)。为了封闭根管系统,建议使用生物活性材料充填。最后,必须进行随访,包括临床和影像学检查,直至牙髓-牙本质复合体完全再生。在图b中,负载GF的个体化支架中GF的存在,诱导趋化反应(即干细胞从根尖迁移),这是细胞归巢方法的第一个阶段。在趋化反应后,细胞开始在载有GF的支架内增殖,数量增加(第二阶段)。然后细胞附着在牙本质内表面(第三阶段),分化为牙髓样细胞(第四阶段)
细胞移植法
细胞移植是将外源性支架和/或干细胞移植到所需位点,以实现组织再生。细胞移植在牙科领域已广泛应用,它首先由Mooney等于1996年提出。该领域的最新进展,包括新型支架/干细胞构建体和治疗剂,证实组织工程可转化应用于牙髓再生治疗中。
有研究使用自组装纳米微球将牙髓干细胞递送到根管中,合成了一种由聚(左旋乳酸)-嵌段-聚-(左旋赖氨酸)构成,能够自组装成纳米纤维海绵微球的星形嵌段共聚物,可在体外支持 DPSC 增殖和牙本质涎磷蛋白表达。还有学者使用纳米微球递送生长因子,通过使用微球平台释放氟轻松(FA)以抑制炎症,同时也释放BMP-2以促进DPSC的牙源性分化;在体外系统中可观察到FA的恒定线性释放和BMP-2的快速释放,可抑制炎症和增强DPSC分化。
最近一项研究将基于甲基丙烯酰基明胶(GelMA)的水凝胶用于牙髓再生。GelMA由变性胶原组成,并保留RGD(即精氨酸-甘氨酸-天冬氨酸)黏附结构域,并对基质金属蛋白酶敏感,从而增强细胞结合和基质降解。研究发现,细胞GelMA构建体可使牙根片段中形成高度细胞化和血管化的人DPSC/脐静脉内皮细胞衍生的牙髓样组织,并促进细胞附着于牙本质内表面,形成伸入牙本质小管中的细胞突以及修复性牙本质基质。总的来说,GelMA水凝胶更适合包裹细胞,并通过改变GelMA和光引发剂的浓度可以很容易地对其进行调节。近期一项研究使用可见光调节GelMA水凝胶,这更接近临床情况,因为临床上常见可见光光固化灯,并且对DNA和细胞功能产生。图2展示了以上策略潜在的临床转化应用。
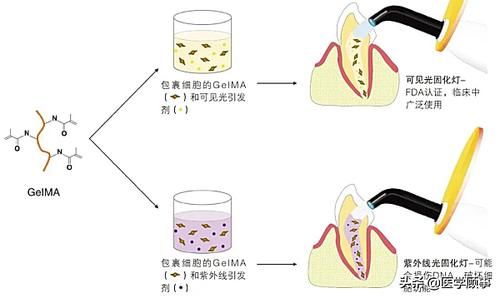
图2 该示意图展示了通过使用可见光使GelMA聚合,制备预血管化的牙髓样组织构建体。首先将明胶与甲基丙烯酸酐混合,然后通过掺入苯基-2,4,6-三甲基苯甲酰基次膦酸锂光引发剂和随后的细胞包埋来合成GelMA大分子单体,细胞包埋是在GelMA水凝胶中混悬细胞。然后将得到的负载细胞的水凝胶构建体置于根管中,使用光固化灯进行聚合。该图片经授权改编自Monteiro等的研究(Monteiro等,2018)
总结和展望
我们将过去几年取得的主要成果列举如下:①与骨髓或脂肪来源的间充质干细胞相比,DPSC具有更强大的血管和神经生成潜力;②将自体DPSC移植到犬的去髓根管中可实现全牙髓再生;③犬的去髓根管中可再生出完整的牙髓,并且冠方形成了牙本质,对其进行观察,可见炎症细胞数量减少,细胞死亡数量下降,神经突显著向外生长。其他临床前试验也证实了干细胞移植机制的有效性和安全性。基于多项研究结果以及现有信息,牙髓再生临床治疗成功的关键是研发出一种生物相容性消毒方法。例如专注于设计和合成具有患者特异性与细胞相容性的3D抗生素洗脱纳米纤维,用于根管内封药,目前正在开展临床前(动物)体内研究以验证其效果。此外,我们还需要开发出一种牙髓再生技术,使用负载或不负载干细胞和生长因子的支架,在无菌环境中促进牙髓和牙本质再生,以建立死髓牙治疗的新方法。
文章来源:《牙体牙髓牙周病学杂志》 网址: http://www.ytysyzbxzzzz.cn/zonghexinwen/2021/0924/521.html